Ursprünglich veröffentlicht am 28. September 2017.
Es ist eine aufregende Zeit für Menschen mit Diabetes in den USA, da wir jetzt gemeinsam mit dem Rest der Welt Zugang zur Abbott FreeStyle Libre Flash-Glukoseüberwachungstechnologie haben.

Abbott Diabetes Care angekündigt später Mittwoch es hatte die FDA-Zulassung für dieses neue Gerät erhalten, das bereits seit mehreren Jahren in Übersee erhältlich ist, aber hier in den USA ein ganzes Jahr und zwei Monate lang im Fegefeuer steckt
Dies ist das erste Gerät dieser Art, das sich von einem herkömmlichen kontinuierlichen Glukosemonitor CGM mit einem Sensor unterscheidet, der Daten direkt auf ein separates Gerät oder eine mobile App überträgt und über Glukosewarnungen verfügt. Stattdessen besteht der Libre aus einem kleinen runden SensorWird am Oberarm getragen, über den der Handscanner des Benutzers verfügt, um so oft oder so wenig wie gewünscht Glukosewerte zu erhalten.
Im Gegensatz zu anderen derzeit in den USA erhältlichen Diabetes-Geräten erfordert der Libre keine Fingerstick-Blutzuckermessung, um die Genauigkeit der Daten zu bestätigen. Dieses Gerät ohne Kalibrierung wurde als a bezeichnet. Game-Changer von Patienten weltweit verwenden.
WAS IST DIE ABBOTT FREESTYLE LIBRE?
Hier ist der Skinny auf dem FreeStyle Libre Sie können auch a schickes 22-Sekunden-Marketingvideo von Abbott.Beachten Sie, dass es einige wesentliche Unterschiede zwischen dem, was jetzt für die USA zugelassen ist, und dem, was weltweit verfügbar ist, gibt :
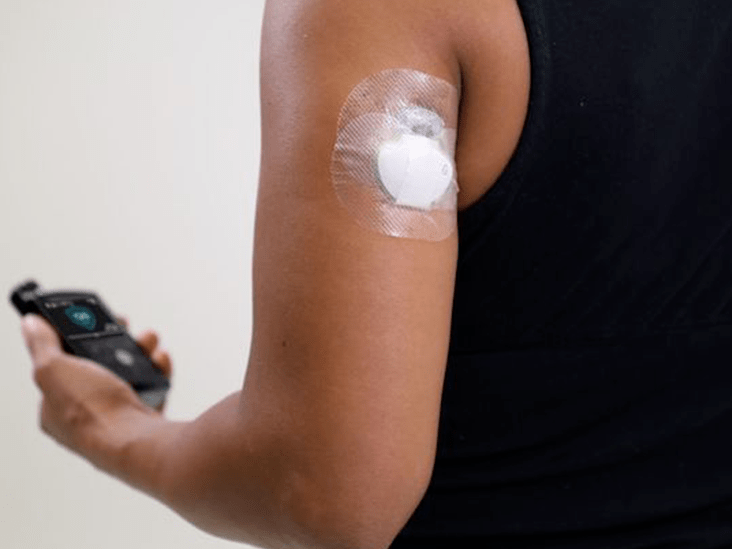
Scannbarer Sensor : Im Gegensatz zu vorhandenen rechteckigen oder schalenförmigen CGM-Sensoren, die ständig Glukosedaten auf einen Empfänger oder eine Smartphone-App übertragen, verfügt der Libre über einen kleinen Disc-Sensor mit der Größe und Dicke von zwei gestapelten Vierteln, und Benutzer halten einfach das Handlesegerät in der Handdarüber von 1 bis 4 cm, um nach Daten zu scannen. Es ist derzeit nur für die Verwendung am Oberarm zugelassen, der mit einem leicht zu drückenden Inserter an der Haut befestigt wird. Er misst jede Minute die interstitielle Flüssigkeit.
Tragezeit : Der Sensor ist für 10 Tage in Amerika zugelassen, nicht für 14 Tage weltweit und mit dem FreeStyle Libre Pro Ärzteversion hier in den USA Die Annahme ist, dass dies eine zusätzliche Sicherheitsvorkehrung der FDA war, die durch ihre anhaltende Unsicherheit über keine Kalibrierungen ausgelöst wurde.
Handleser : Ähnlich wie der OmniPod PDM ähnelt dieses Gerät einem der herkömmlichen Glukosemessgeräte von Abbott, ist jedoch kleiner als ein neueres iPhone. Es verwendet einen Micro-USB zum Aufladen und scannt den Sensor innerhalb weniger Sekunden - sogar durch Kleidungeinschließlich dicker Wintermäntel und Lederjacken. Es verfügt über ein hintergrundbeleuchtetes Touchscreen-Farbdisplay und speichert Messwerte für bis zu 90 Tage. Der Sensor selbst kann jedoch nur Daten im Wert von 8 Stunden speichern, sodass Sie diese mindestens einmal scannen müssenDies bedeutet, dass Libre in dieser Zeit nicht alle Glukosedaten erfassen kann, wenn Sie den Leser vor einem langen Tag zu Hause lassen oder länger als acht Stunden schlafen.Fanggerät mit einem gut lesbaren Bildschirm auch im Sonnenlicht, wird uns gesagt! und es bekommt sicherlich Punkte für Stil.
Keine routinemäßigen Fingersticks : Dies ist riesig und markiert einen Wendepunkt in der Welt der D-Geräte hier in den USA, da derzeit kein anderes Gerät von der FDA für Nullkalibrierungen zugelassen ist. Sowohl Dexcom als auch Medtronic erfordern mindestens zweimal täglich Fingerstick-Kalibrierungen.Obwohl das Dexcom G5 Mobile-System einen „nicht-zusätzlichen Zusatz“ -Anspruch der FDA erhalten hat, bedeutet dies, dass es Patienten gestattet ist, auf der Grundlage dieses Systems Behandlungs- und Insulindosierungsentscheidungen zu treffen. Der Libre hat jetzt auch diese Bezeichnung, wobei die FDA ausdrücklich angibt: Fingerstick-Tests sind nicht erforderlich, um geeignete Pflegeentscheidungen zu treffen oder den Glukosespiegel mit diesem System zu kalibrieren. "Es wird jedoch weiterhin empfohlen, dass Benutzer einen Fingerstick-Test durchführen, wenn das System das Symbol" Blutzucker prüfen "anzeigt, wenn die Daten ungenau erscheinen oder wenn der Patient Symptome oder Krankheiten hat.
Eingebautes Messgerät : Auch wenn es sich um ein Gerät ohne Kalibrierung handelt, bedeutet dies nicht, dass manchmal noch keine Fingersticks erforderlich sind wie oben angegeben. Der Libre verfügt daher über ein eingebautes Blutzuckermessgerät, das Freestyle-Streifen verwendet. Also neinNotwendigkeit für "routinemäßige" Fingersticks, aber Benutzer können immer noch hin und wieder mit den Fingern nach Blutstropfen stechen.
Blitz, nicht kontinuierlich : Um klar zu sein, obwohl die FDA dies unter dem Dach von CGM kategorisiert, ist dieses neue Flash Glucose Monitoring FGM-System, anstatt eine völlig neue Gerätekategorie zu erstellen. nicht dasselbe so kontinuierliche Glukoseüberwachung wie wir sie kennen. Wie bereits erwähnt, müssen Sie das mobile Gerät über den Sensor scannen, um Messwerte zu erhalten. ohne Alarme für niedrigen oder hohen Blutzucker in Echtzeit, und die Daten werden derzeit nicht auf mobile Geräte wie Smartphones gestreamt weitere Informationen zu Konnektivitätsfunktionen weiter unten. Das mobile Handgerät zeigt Trenddaten an, darunter Tiefs, stabile und hohe Messwerte mitein Richtungspfeil und die Möglichkeit, 8 Stunden Glukoseverlauf zu überprüfen.
Aufwärmphase : Sobald Sie den Sensor eingesetzt und gestartet haben, dauert es 12 Stunden, bis die tatsächlichen Glukosedaten angezeigt werden. Dies ist ein Nachteil, da er erheblich länger ist als die in anderen Ländern zulässige Aufwärmzeit von 1 Stunde.und es erinnert an das Abbott FreeStyle Navigator CGM, das vor Jahren eine vollständige Aufwärmphase von 10 Stunden hatte, bevor Daten angezeigt wurden. Dies wurde nicht von der FDA vorgeschrieben, sondern anscheinend von Abbott selbst implementiert, um die Leistung zu verbessern - dh von dem, was wir habenWenn Sie von Benutzern im globalen DOC hören, werden die Libre-Daten mit der Zeit genauer, insbesondere nach den ersten 24 Stunden nach dem Starten eines Sensors.
Nicht für Kinder : Die FDA-Zulassung gilt für Personen ab 18 Jahren, was bedeutet, dass sie für Kinder nicht offiziell zugelassen ist. Wie viele in der D-Community wissen, sind Ärzte möglicherweise bereit, ein „Off-Label“ -Rezept zu schreiben. Die Meinung Ihres Arztes kann variierenWir konnten von Abbott keine näheren Angaben zu ihren Plänen oder ihrem Zeitplan für die pädiatrische Zulassung erhalten.
wasserdicht : Laut offiziellen Marketingmaterialien kann der Libre-Sensor beim Baden, Duschen und Schwimmen getragen werden, solange er nicht tiefer als 3 Fuß ist oder länger als 30 Minuten unter Wasser gehalten wird.
Tylenol OK : Abbotts erste Pressemitteilung forderte die Benutzer auf, Paracetamol Bestandteil von Tylenol und Hunderten anderer Medikamente zu vermeiden, aber jetzt scheint die Warnung entfernt worden zu sein. Die FDA sagt, dass dies nach der Libre Pro-Version kein Problem mehr darstellt. vor kurzem wurde das Etikett geändert spiegelt dasselbe wider.
Genauigkeit : britische Studiendaten zum Libre zeigt, dass es einen Genauigkeitsstandard hat, der den beiden hier in den USA vorhandenen CGMs ziemlich ähnlich ist, was den Vergleich mit dem Dexcom G5 und dem neuesten Guardian-Sensor von Medtronic betrifft, sobald diese im realen Leben nebeneinander getestet werden.
Bessere Ergebnisse : Abbott Diabetes Care präsentiert seit mehr als einem Jahr klinische Daten auf Konferenzen darüber, wie viel besser PWDs mit diesem Libre umgehen - hauptsächlich aufgrund seiner einfachen Handhabung. Klinische Studien und reale Beweise, die im letzten Jahr oder so veröffentlicht wurden, zeigen, dass PWDs in der Lage sind, das Ausmaß der Hypoglykämie zu senken, ohne A1Cs zu erhöhen, und dass sie im Allgemeinen besser abschneiden als diejenigen, die herkömmliche Fingersticks verwenden. Fazit : je mehr Libre-Scans, desto besser das D-Management
ZEIG MIR DIE DATEN…
Bei aller Begeisterung für eine verbesserte gemeinsame Nutzung und Anzeige von Daten in den USA verfolgt der Libre an zwei Fronten einen einzigartigen Ansatz :
- Keine anfängliche Konnektivität : Zum Zeitpunkt des Starts bietet Abbott keine Konnektivität für den Libre mit einem mobilen Gerät oder Smartphone an, obwohl dies außerhalb der USA mit dem verfügbar ist. LibreLink Mobile App, mit der Benutzer ihren Handleser sogar zu Hause lassen und einfach mit ihrem Smartphone den Sensor direkt scannen können. Dies ist eine „zukünftige Iteration“ für die USA, aber Abbott hat noch keine Zeitleiste benannt.
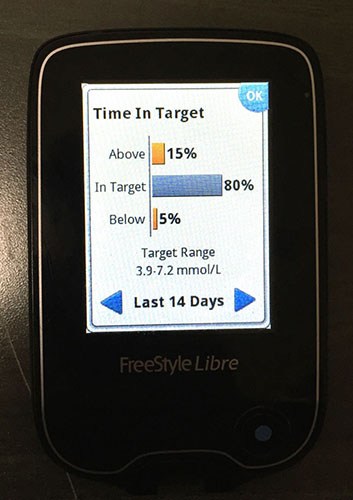
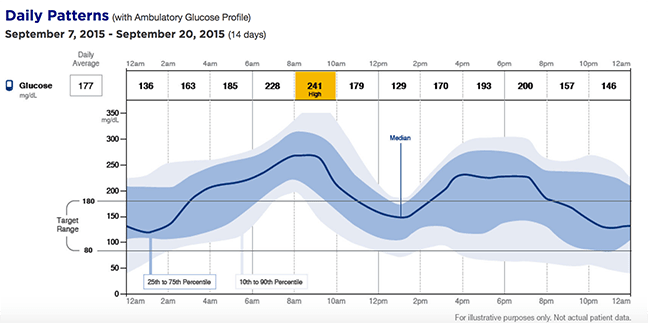
- Ein neuer Standard für die Datenanzeige : Der Libre bietet eine visuelle Momentaufnahme der Glukoseschwankungen einer Person während eines typischen Tages namens Ambulantes Glukoseprofil AGP . Dies zeigt hypoglykämische und hyperglykämische Trends in einer neuen Sichtweise und wird branchenweit als ein möglicher Weg zur Standardisierung der Anzeige von Diabetesdaten diskutiert; die American Association of Clinical Endocrinologists AACE hat kürzlich empfohlen die die Gesundheitsbranche im gesamten AGP-Bericht standardisiert alle Glukoseüberwachungsgeräte für Patienten und Ärzte.
VERFÜGBARKEIT UND KOSTEN
Abbott teilt uns mit, dass der Libre ab Dezember 2017 verschreibungspflichtig in US-Apotheken erhältlich sein wird.
Natürlich strebt Abbott Medicare- und privaten Versicherungsschutz an, aber wir warten immer noch darauf zu hören, ob das Unternehmen auch die Hürden für dauerhafte medizinische Geräte Durable Medical Equipment, DME der Zahler umgehen wird, damit Apotheken den Libre direkt an PWDs verkaufen können.
Kosten : Dies sind die Details, wie die Libre-Preise aussehen -
- Die empfohlenen Verkaufskosten für die Sensoren betragen jeweils 36 USD - weniger als für Dexcom-Sensoren mit jeweils 88 USD und die CGM-Sensoren von Medtronic, die 94 USD für die Enlites und 108 USD für den neuen Guardian 3 einläuten. Die Preise können je nach Apotheke variieren.
- Der Handempfänger kostet nur 70 US-Dollar und ist praktisch kostenlos im Vergleich zum vierstelligen Preis eines Dexcom-Systems und den noch höheren Kosten eines Medtronic-Pump-CGM-Systems.
- Auch wenn keine routinemäßigen Fingersticks und Kalibrierungen erforderlich sind, benötigen Sie dennoch Teststreifen. Diese Kosten variieren natürlich je nach Marke und anderen Faktoren.
Medicare-Deckung : Am 4. Januar 2018 Abbott kündigte an, dass die Libre von Medicare abgedeckt wird da keine Kalibrierungen erforderlich sind und die Klassifizierung „Therapeutisches CGM“ für die Abdeckung erfüllt wird sofern die Zulassungskriterien erfüllt sind.
Das Unternehmen gibt auch keine endgültigen Preisinformationen bekannt, bis die Markteinführung zum Jahresende näher rückt, aber Abbott-Sprecherin Vicky Assardo sagt, dass die Preisgestaltung dem Preis in Europa „sehr ähnlich“ sein wird - wo der Leser jeweils etwa 69 US-Dollar kostetDer Sensor kostet ohne Versicherung etwa 70 US-Dollar aus eigener Tasche. In Australien werden die Geräte ohne Deckung für jeweils etwa 95 US-Dollar aus eigener Tasche verkauft.
„Wir haben das Produkt absichtlich so konzipiert, dass es so erschwinglich wie möglich ist“, sagte Jared Watkin, Senior Vice President von Abbott Diabetes Care. Chicago Tribune .
Bei der Firma Libre-Website mit einigen positiven Nachrichten von “ 'Sie können dies tun' ohne Fingersticks , ”Es besteht die Möglichkeit, sich für Benachrichtigungen zu den neuesten Nachrichten anzumelden und auf Updates zur Verfügbarkeit von Libre zuzugreifen.
ABBOTT'S ROCKY ROAD

Diese Einführung markiert ein mit Spannung erwartetes Comeback für Abbott in der innovativen Diabetes-Technologie hier in den USA, nachdem sich das Unternehmen seitdem weitgehend auf grundlegende Glukosemessgeräte und -streifen konzentriert hat. Verkauf des FreeStyle Navigator CGM eingestellt im Jahr 2010. Es war über die Jahre ein steiniger Weg, besonders mit große Produktrückrufe die das Vertrauen der Diabetes Community in das Unternehmen erschüttert haben.
Abbott reichte die Libre Mitte 2016 bei der FDA ein, volle zwei Jahre danach wurde in Europa erhältlich im Jahr 2014. Diese Consumer-Version folgt der professionellen, verblindeten Version, die Ärzten zur Verfügung steht und im September 2016 für die USA zugelassen wurde. Genehmigung von Health Canada des Verbrauchers Libre für dieses Land im Juni und der aktuelle NHS-Ankündigung dass es bald beginnen wird, dieses Gerät abzudecken. Insgesamt nutzen weltweit mehr als 400.000 Menschen den Libre in 40 Ländern.
Die FDA hat tatsächlich eine eigene herausgegeben
„Die FDA ist immer an neuen Technologien interessiert, die dazu beitragen können, die Versorgung von Menschen mit chronischen Erkrankungen wie Diabetes einfacher und leichter zu handhaben“, sagte Donald St. Pierre von der FDA, amtierender Direktor des Office of In VitroDiagnostics and Radiological Health und stellvertretender Direktor für die Bewertung neuer Produkte im Zentrum für Geräte und radiologische Gesundheit der Agentur: „Mit diesem System können Menschen mit Diabetes den zusätzlichen Schritt der Fingerstick-Kalibrierung vermeiden, der manchmal schmerzhaft sein kann, aber dennoch die für die Behandlung erforderlichen Informationen liefertihr Diabetes - mit einer Welle des mobilen Lesegeräts. ”
DIE ZUKUNFT MIT LIBRE
Dies ist eine große Entwicklung, die den Weg für die Technologie der nächsten Generation ebnet. Sie hat bereits Auswirkungen auf den bestehenden Markt für D-Geräte, wobei der Konkurrent Dexcom eine bedeutende Rolle spielt. Aktienkurs getroffen nach frühen Nachrichten über die Zustimmung von Libre. Es überrascht nicht, dass Abbotts Aktienkurs am Mittwoch nach der Ankündigung um 4% gestiegen ist.
Ob Libre die Hauptkonkurrenten Dexcom und Medtronic nachhaltig beeinflussen wird, ist derzeit unklar, da Libre keinen kontinuierlichen Datenstrom oder Alarm bietet - große Faktoren für viele aktuelle CGM-Benutzer. Dexcom hat viel zu bietenebenso wie Medtronic mit dem neuen Minimiertes 670G-Hybrid-Closed-Loop-System obwohl Herausforderungen bei der Sensorherstellung zu einer verzögerten Produkteinführung und Frustration in der D-Community geführt haben.
Dexcom plant bereits, seinen zukünftigen Sensor, den G6, in den kommenden Monaten vorzulegen. Die Markteinführung ist für 2018 geplant. Zwar wird ein Verschleiß von 10 Tagen mit besserer Genauigkeit erwartet, derzeit wird jedoch noch ein einziger erwartettägliche Kalibrierungsanforderungen. Die Generationen darüber hinaus gehen in Richtung des allgemeinen Ziels von Dexcom, keine Kalibrierungen vorzunehmen, und diese Libre-Zulassung trägt dazu bei, dies besser zu ermöglichen.
Sicher, für diese aktuelle Version von Libre ist ein Handheld-Gerät erforderlich, um nach Daten zu suchen. Wir wissen jedoch, dass die nächste Generation in der Entwicklung kein manuelles Scannen erfordert, sondern über direkte Datenkommunikationsfunktionen verfügt ähnlich wie das G5 von Dexcom derzeit übereine mobile App. Es gibt noch keine ETA für dieses Produkt der nächsten Generation.
Startup Bigfoot Biomedical, das das gemacht hat mutige Entscheidung, Abbotts Next-Gen-System zu verwenden mit ihrem zukünftigen automatisierten Insulinabgabesystem, bevor die Libre überhaupt die FDA-Zulassung erhalten hat, sieht diese neue Zulassung einen bahnbrechenden Schritt nach vorne. Gründer und D-Dad Jeffrey Brewer verwendet Wörter wie „Durchbruch“ und „dramatischer Fortschritt“ bei der Beschreibung derLibre.
„Alle Technologien, die ich in den letzten zehn Jahren gesehen habe, haben nur mehr Leistung geliefert, aber auf Kosten der Lebensqualität“, sagt er und merkt an, dass der Libre trotz der Variationen der weltweit vermarkteten Versionen einen QOL-Schub bietet. “Wichtig ist, dass Abbott das Produkt als Ersatz für Fingersticks bei der Insulindosierung anzeigen konnte - daher war über den gesamten Zeitraum von 10 Tagen keine Fingerstick-Kalibrierung erforderlich. “
Brewer sagt, er sei begeistert von der Zusammenarbeit mit Abbott, und diese behördliche Genehmigung hält alles auf dem richtigen Weg für einen entscheidenden Teststart für das Bigfoot-System im Jahr 2018.
Wir wiederholen diese Aufregung und senden Abbott unsere Glückwünsche, dass er es endlich zu diesem Meilenstein geschafft hat. Wir können es kaum erwarten zu sehen, wie sich PWDs hier in den USA über das neue Libre-System fühlen!
** UPDATE : Am 27. Juli 2018 genehmigte die FDA eine neue 14-Tage-Version des Abbott FreeStyle Libre-Systems mit verbesserter Genauigkeit und nur einer Aufwärmphase von 1 Stunde im Vergleich zur anfänglichen Wartezeit von 10 Stunden! Abbott geht davon aus, dass der Start in den USA in den kommenden Monaten bis Herbst 2018 erfolgen wird.