Das MS-Medikament Lemtrada von Genzyme entspricht nicht den FDA-Anforderungen.
Drugmaker Genzyme wurde letzte Woche ein schwerer Schlag versetzt, als sein Medikament gegen Multiple Sklerose MS Lemtrada von der Food and Drug Administration FDA abgelehnt wurde. In der Entscheidung der FDA wurde die Notwendigkeit weiterer Studien zum Nachweis der Wirksamkeit und Sicherheit des Arzneimittels angeführtDie Aufsichtsbehörden genehmigten Lemtrada im September 2013.
Lemtrada, auch bekannt als Campath-1H oder Alemtuzumab, hat einen langen und kurvenreichen Weg bis vor die Haustür der FDA zurückgelegt. „Campath“ steht für Cambridge Pathology, wo die Eigenschaften der monoklonalen Antikörper erstmals als potenzielle Behandlung für Krankheiten erkannt wurden.
Nach dem Universität von Cambridge „Die ursprüngliche Absicht war die Verwendung von Alemtuzumab zur Behandlung von Leukämie. 1990 begannen Alastair Compston und Herman Waldmann Diskussionen über die Anwendung von Alemtuzumab bei Multipler Sklerose.“
Alemtuzumab wurde 2001 zur Behandlung der chronischen lymphatischen Leukämie CLL zugelassen, aber auch zur Behandlung von Autoimmunerkrankungen wie rheumatoider Arthritis, Leukämie und MS untersucht.
Obwohl das Medikament MS-Rückfälle stoppte, stellten Forscher, die Alemtuzumab bei sekundär progressiven MS-Patienten untersuchten, fest, dass sich ihr Zustand weiter verschlechterte. Um den Nutzen des Medikaments zu maximieren, müssten Patienten früher in ihrer Krankheit behandelt werden, bevor sich Nervenschäden ansammeln.
Kennen Sie die Frühwarnzeichen von MS »
Die Lizenz des Arzneimittels wechselte viele Male den Besitzer, bevor sie 2004 in das Portfolio von Genzyme aufgenommen wurde. Als die MS-Studien von Genzyme nach 2004 vielversprechend wurden, verschrieben Neurologen sie „off label“ für einen anderen Zweck als die von der FDA genehmigte Absicht eines ArzneimittelsMS-Patienten.
Im September 2012 traf Genzyme in Erwartung der FDA-Zulassung von Alemtuzumab für MS unter dem Namen Lemtrada die umstrittene Entscheidung, das Medikament vom US-Markt zu nehmen. Dies hinderte Neurologen effektiv daran, es ihren MS-Patienten zu verschreiben.
Um Menschen mit CLL Zugang zu dem Medikament zu verschaffen, hat Genzyme das “ US Campath Distribution Program . ”Das Programm ermöglichte es Leukämiepatienten, Campath kostenlos direkt von Genzyme zu erhalten, das jetzt dem Pharmagiganten Sanofi gehört, mit der Auflage, dass es nur wie angegeben verwendet werden darf.
Ein wichtiger Knackpunkt bei der FDA ist, dass Lemtrada-Studien nicht doppelblind waren, was bedeutet, dass die Ärzte und Patienten wussten, welche Probanden Lemtrada erhielten und welche ein Placebo erhielten.
"Die FDA hat die Studien mit Lemtrada dafür kritisiert, dass sie nicht versucht haben, die Studienteilnehmer und Ärzte für ihre Behandlung zu blenden, und sich auf einen verblindeten Bewerter verlassen, um die Wirksamkeit von Lemtrada zu beurteilen", sagte Dr. Alasdair Coles, ein akademischer Neurologe.Es ist jedoch nicht möglich, Menschen für die unmittelbaren Nebenwirkungen von Lemtrada zu blenden, und alle MS-Studien beruhen auf einem verblindeten Bewerter. Ich bin weiterhin zuversichtlich, dass die Ergebnisse dieser Studien vorliegen. “
Laut FDA sind weitere klinische Studien erforderlich, um zu zeigen, dass Lemtrada sowohl MS-Patienten zugute kommt als auch keine potenziell schwerwiegenden Nebenwirkungen verursacht.
Dr. Coles, Ph.D. FRCP, Erstautor von zwei Artikeln, in denen Phase-3-Studien mit Alemtuzumab gegen MS beschrieben wurden, teilte GesundLinie seine Ansichten zur FDA-Entscheidung mit.
„Es ist sehr enttäuschend, dass die FDA Lemtrada nicht für die Behandlung von Multipler Sklerose zugelassen hat“, sagte Coles. „Dies beraubt Menschen mit Multipler Sklerose in den USA einer wichtigen Behandlungsoption, die in ganz Europa und Kanada verfügbar istund Australien. ”
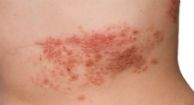
Das Medikament hat mehrere Nebenwirkungen einschließlich Übelkeit, Müdigkeit, Fieber und einer Verringerung der weißen Blutkörperchen, die das Immunsystem schwächt und Patienten anfälliger für Infektionen macht. In klinischen Studien entwickelten 30 Prozent der Patienten, die Lemtrada einnahmen, sekundäre Autoimmunerkrankungen, meistens eine Untererkrankung-aktive oder überaktive Schilddrüse. Aber Coles sagt, dass es immer noch eine bessere Option als Interferon Beta ist, das grippeähnliche Symptome verursachen kann und nicht während der Schwangerschaft oder Stillzeit eingenommen werden kann.
„Lemtrada ist nicht für alle Menschen mit Multipler Sklerose geeignet, da es schwerwiegende Nebenwirkungen hat, die eine sorgfältige Überwachung erfordern. Es ist jedoch wirksamer als Interferon Beta bei der Reduzierung von Rückfällen und Behinderungen und attraktiv für diejenigen, die an aggressiver Multipler Sklerose leiden oder nicht.“Ich mag keine häufigen Injektionen oder möchte Kinder haben “, sagte Coles.
Genzyme legt Berufung gegen die FDA-Entscheidung ein und kann ihre Studien neu gestalten, um die FDA-Anforderungen zu erfüllen. Für Patienten, die in klinischen Studien auf Lemtrada angesprochen haben - sowie für Patienten, die es off-label genommen haben - ist dies möglicherweise wenig tröstlich.